好博士研究成果丨比较静脉化疗与内科闭合式床旁体腔热灌注化疗顺铂的药代动力学研究
比较顺铂经胸腔热灌注化疗(Hyperthermic intrathoracic chemotherapy,HITHOC)和腹腔热灌注化疗(Hyperthermic intraperitoneal chemotherapy,HIPEC)与静脉化疗(Intravenous chemotherapy,IVC)的药代动力学和不良反应的差异。
发布时间:
2025-09-03
来源:
比较静脉化疗与内科闭合式床旁体腔热灌注化疗顺铂的药代动力学研究
宋杰,张涛,廖成功,侯艳,胡雯,王赟,陈东旭,陈雨,刘理礼
空军军医大学第二附属医院肿瘤科,陕西西安710038
【摘要】目的:比较顺铂经胸腔热灌注化疗(Hyperthermic intrathoracic chemotherapy,HITHOC)和腹腔热灌注化疗(Hyperthermic intraperitoneal chemotherapy,HIPEC)与静脉化疗(Intravenous chemotherapy,IVC)的药代动力学和不良反应的差异。方法:选取60名在我科接受以顺铂为基础的IVC、HITHOC或HIPEC的患者,用HPLC法测定灌流液及血浆中的顺铂浓度,比较三组患者的曲线下面积(area under curve,AUC)及不良反应的差异。结果:HITHOC组患者灌流液中顺铂AUC0-24 h的均值为72.36µg/mL·h,明显高于HIPEC组的均值36.03µg/mL·h,差异有统计学意义(P<0.01)。IVC、HITHOC和HIPEC组患者血浆中顺铂AUC0-24 h的均值分别为:3.15µg/mL·h、2.57µg/mL·h、3.02µg/mL·h,差异有统计学意义(P<0.01),两两比较发现,IVC组和HITHOC组的差异有统计学意义(P<0.01),IVC组和HIPEC组的差异无统计学意义(P=0.47),HITHOC组和HIPEC组的差异有统计学意义(P=0.01)。三组患者的常见不良事件发生率无显著差异(P<0.05)。结论:内科式HITHOC无法达到相同剂量顺铂IVC的全身治疗效果,内科式HIPEC可达到相同剂量顺铂IVC的全身治疗效果。
【关键词】胸腔热灌注化疗;腹腔热灌注化疗;静脉化疗;顺铂;药代动力学
Study on Pharmacokinetics of intravenous chemotherapy of Cisplatin and Intrapleural hyperthermic Perfusion chemotherapy in Internal Medicine
SONG Jie,ZHANG Tao,LIAO Chenggong,HOU Yan,HU Wen,WANG Yun,CHEN Dongxu,CHENYu,LIU Lili
Department of Oncology,The Second Affiliated Hospital,The Air Force Medical University,Shaanxi Xi’an 710038,China.
【Abstract】Objective:To compare the pharmacokinetics and adverse reactions of cisplatin with hyperthermic intrathoracic chemotherapy(HITHOC),hyperthermic intraperitoneal chemotherapy(HIPEC)and intravenous chemotherapy(IVC).Methods:60 patients who received cisplatin-based IVC,HITHOC or HIPEC in our department were selected.The concentration of cisplatin in perfusate and plasma was determined by HPLC method.The area under curve(AUC)and adverse reactions of the three groups were compared.Results:the mean value of AUC0-24 h of cisplatin in HITHOC group was 72.36µg/mL·h,which was significantly higher than that in HIPEC group(36.03µg/mL·h).The mean value of plasma cisplatin AUC0-24 h in IVC,HITHOC and HIPEC groups was 3.15µg/mL·h,2.57µg/mL·h and 3.02µg/mL·h respectively.There was significant difference between IVC group and HITHOC group,but there was no significant difference between IVC group and HIPEC group.There was significant difference between HITHOC group and HIPEC group(P=0.01).There was no significant difference in the incidence of common adverse events among the three groups(P<0.05).Conclusion:HITHOC can not achieve the systemic therapeutic effect of the same dose of cisplatin IVC,and HIPEC can achieve the systemic therapeutic effect of the same dose of cisplatin IVC.
【Keywords】advanced colorectal cancer,anlotinib,efficacy,safety
背景
胸膜和腹膜转移导致的恶性胸腹水是严重危害晚期恶性肿瘤患者生活质量的并发症之一。恶性胸腹水导致的胸闷、气短、呼吸困难、疼痛、腹胀、肠道梗阻等诸多症状,不仅严重影响患者的生活质量,也大大缩短了患者的生存期[1]。对于这些患者,外科手术和局部放射治疗疗效有限。传统的利尿、限钠、穿刺抽液等治疗仅能暂时缓解症状,无法从根本上有效控制恶性胸腹水的产生,尤其是经过反复穿刺抽液治疗的患者,很容易发生电解质紊乱及低蛋白血症等并发症。且由于胸腹膜表面的血液供应较差,导致了静脉化疗(intravenous chemotherapy,IVC)时胸腹腔内药物浓度过低,难以控制恶性胸腹水。
胸腹腔热灌注化疗是将化疗药物配成灌注液,再通过体腔热灌注治疗机进行恒温循环(43℃)的一种新型治疗方式:根据肿瘤热疗学原理,利用热杀伤机制,以生理盐水为热能载体,将经过体外加热的生理盐水灌注于胸腹腔,使热能均匀散布于胸腹腔及脏器间,通过对出体显示温度的监测,调整入体显示温度使胸腹腔内温度在有效范围内(41~43℃)保持一定时间(同时配以热敏感性好的化疗药物),通过温热对广泛种植在浆膜上的癌细胞造成杀伤,使受累浆膜和积液中的癌细胞变性死亡,并清洗排出体外,消除引发恶性积液的病因,从而达到有效治疗恶性积液和胸腹腔内转移种植癌的目的。体腔热灌注治疗机开发的一套集控制、监测和安全联锁保护于一体的自动化控制系统,能精确控制胸腹腔灌注温度,使患者无痛耐受全程治疗,从而实现化学药物(化疗)与物理治疗(热疗)的联合,达到1+1>2的效果[2-5]。
随着体腔热灌注治疗机的技术进步,胸腔热灌注化疗(hyperthermic intrathoracic chemotherapy,HITHOC)和腹腔热灌注化疗(Hyperthermic intraperitoneal chemotherapy,HIPEC)已成为治疗恶性胸腹水的有效方法,得到了多个指南和专家共识的推荐[6-8]。近年来,许多医院都引入了胸腹腔热灌注化疗技术。然而,不同中心的灌注方法却不尽相同,从而导致了疗效、不良反应的差异。目前临床上常用的胸腹腔热灌注化疗方式主要有外科式和内科式两种,外科式多在开放或腔镜手术时留置胸腹腔引流管,在术中或术后进行胸/腹腔热灌注化疗[9]。此方式需要在全麻手术中置管,损伤较大,且多在1-3次治疗后拔管,难以反复手术置管,重复性差[10]。内科式胸腹腔热灌注化疗是在床旁超声引导下行胸腹腔穿刺置管[11],此方式仅需局部浸润麻醉,损伤较小,且可以多次穿刺置管,重复性好,可进行多周期治疗。
我们曾回顾性分析了315例胸膜癌患者及670例腹膜癌患者使用TRL热灌注机进行床旁HITHOC/HIPEC的安全性,这些患者在我科共完成1510次HITHOC和4249次HIPEC,与HITHOC/HIPEC相关的死亡率为零,HITHOC相关不良反应发生率为2.0%,主要为气胸(0.6%)、胸膜反应(0.3%)、穿刺部位疼痛(0.5%)和灌注失败(0.3%);HIPEC相关不良反应发生率为2.4%,其中HIPEC手术失败1.3%,穿刺点疼痛0.5%,细胞毒剂所致腹膜炎症0.1%,肠梗阻0.1%,肠穿孔0.07%[12]。进而,我们采用前瞻性随机对照研究证实了对于D2根治术后局部进展期的胃癌患者,辅助性HIPEC的疗效优于静脉化疗,安全性及耐受性良好[13]。
我们在以往恶性胸腹水患者的治疗中观察到HITHOC和HIPEC所用的药物剂量是决定疗效的关键所在,但目前尚无统一的剂量标准,国内外的专家共识目前推荐的是参考IVC的剂量,然而,前瞻性胸腹腔给药与静脉给药的血药浓度以及不良反应的差异尚鲜有相关报道。
顺铂是胸腹腔热灌注化疗的常用药物,在肺癌、卵巢癌、胃癌等多种实体瘤导致的恶性胸腹水的灌注治疗中广泛应用。目前报道的胸腹腔热灌注化疗的顺铂剂量从50 mg/m2到高达250 mg/m²,治疗时间从30 min到120 min不等[11,14-16]。关于顺铂HITHOC和HIPEC的药代动力学研究有很多[17,18],也有I期剂量递增试验探索了顺铂HIPEC的最佳给药剂量[19]。但这些研究所采用的均为外科式HITHOC或HIPEC,大都在术中姑息减瘤后进行胸腹腔内给药,且均未与经静脉给药进行对比。目前,HITHOC和HIPEC与静脉给药方式的药代动力学及不良反应差异尚未见报道。
因此,本研究比较了顺铂行IVC和内科床旁胸腹腔热灌注化疗的药代动力学差异及不良反应,旨在探索内科床旁胸腹腔热灌注化疗的最佳给药剂量,为HITHOC及HIPEC的个体化用药奠定基础。
1.材料与方法
1.1.患者入排标准
纳入标准:年龄18~80岁;经病理学确诊为恶性肿瘤;拟在我科接受以顺铂为基础的IVC、HITHOC或HIPEC;美国东部肿瘤协作组(ECOG)体力状况评分在0~2分;血常规和肝肾功能检查均在正常范围;患者依从性好,能够遵循研究程序。
排除标准:血红蛋白低于80g/L,不宜额外采血的患者;预期存活时间小于2个月;存在未控制的严重感染或难以纠正的出血;妊娠期或哺乳期;对本试验用药及其辅助用药过敏;不同意或不遵守研究方案。
根据患者所接受的治疗方式,将患者分为IVC组、HITHOC组和HIPEC组。第四军医大学唐都医院医学伦理委员会批准了这项研究(第202103-29号),所有患者均获得书面知情同意书。
1.2.治疗方法
所有患者的顺铂用量均为75 mg/m2,分3次给药,治疗第1天的顺铂用量均为40 mg,本研究仅对比治疗第1天的药代动力学参数。
IVC组将40 mg顺铂溶于250 mL生理盐水中,静脉输注,1h左右输完。所有患者均给予常规静脉补液水化利尿治疗,以防止肾功能损害,同时根据患者情况,给予止吐药物。
治疗前,在床旁超声引导下,HITHOC组患者于患侧背部在B超引导下根据胸水的定位在不同肋间、HIPEC组患者于左下腹和右下腹确定2个积液较深的部位作为穿刺点,在常规消毒、铺洞巾、局部浸润麻醉成功后,经胸/腹腔穿刺技术留置2个引流管,分别用作入水口和出水口(图1、图2)。置管成功后连接循环管路,用生理盐水建立循环。值得注意的是,对于存在恶性胸腹水的患者,在建立循环前需用生理盐水进行单向冲洗,直至积液颜色清亮为止,这一过程称为积液置换术(图3)。
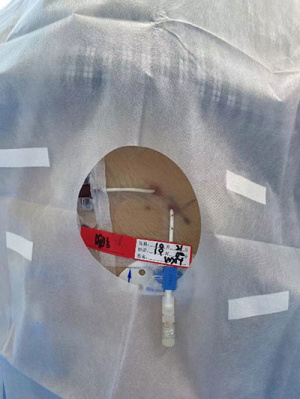 | 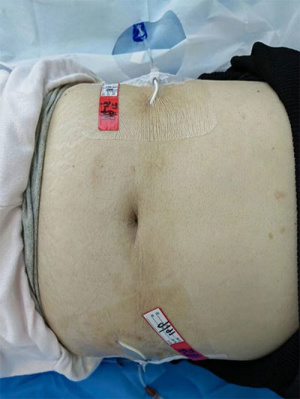 |
图1 内科式HITHOC Figure1 Medical HITHOC | 图2 内科式HIPEC Figure2 Medical HIPEC |
 | |
图3 积液置换术 Figure3 Fluid replacement surgery | |
冲洗完毕后,闭合循环管路建立热灌注循环,在建立有效循环5 min后将40 mg顺铂溶于40 mL生理盐水中,由循环管路的注药口注入胸/腹腔,将灌注液入体温度控制在43℃,灌流速度控制在400 mL/min左右,出体温度保持在41±1℃之间,通过体腔热灌注治疗机持续循环60 min。循环结束后保留灌注液,待其自然吸收,嘱患者每20~30 min变换一次体位,共2次。
所有患者均给予常规静脉补液、水化利尿治疗,以防肾功能损害,同时根据患者情况,在化疗前给予止吐药物。
1.3.灌流液和血液取样
IVC组患者在治疗开始的第0.5、1、1.5、2、3、5、10、16、24 h采集静脉血2 mL,HITHOC组和HIPEC组患者在上述时间点采集静脉血及灌流液各2 mL。每次采集静脉血之前,先抽取1 mL血液丢弃,再将血样放入经肝素处理过的试管中。灌流液和血液样本于采集后的30 min内在4°C(3000 r/min,10 min)下离心。离心后,将所得灌流液和血浆样本储存在−80°C冰箱中,并在2天内进行分析。
1.4.HPLC法测定灌流液和血浆的顺铂血药浓度
将冰冻人灌流液及血浆样品在常温下解冻,用HPLC法测定其中的顺铂含量。
灌流液的测定方法如下:将200μL灌流液和200μL甲醇混合在离心管中,混合物旋转5min,然后在4℃下以12000 r/min的速度离心5min,将上清液层转移到干净的干燥离心管中,加入100ul的1%二乙基二硫代氨基甲酸钠(sodium diethyldithiocarbamatre,DDTC),在40℃下孵育2h,冷却至常温,加入1ml的三氯甲烷,旋转5min,然后在25℃下以12000 r/min的温度离心5min,吸取三氯甲烷层800ul,在氮气中蒸发至干燥,干残留物用70μL的乙腈进行复溶,再将10μL的样品液进样到分析柱上进行HPLC分析。
血浆的测定方法如下:将500μL血浆和500μL甲醇混合在离心管中,混合物旋转5min,然后在4℃下以12000 r/min的速度离心5min,将上清液层转移到干净的干燥离心管中,加入100ul的1%DDTC,在40℃下孵育2h,冷却至常温,加入1ml的三氯甲烷,旋转5min,然后在25℃下以12000 r/min的温度离心5min,吸取三氯甲烷层800ul,在氮气中蒸发至干燥,干残留物用70μL的乙腈进行复溶,再将20μL的样品液进样到分析柱上进行HPLC分析。
色谱柱:Ultimate®XB-C18(月旭科技,250 mm×4.6 mm,5µm);检测波长:254 nm;流动相比例:甲醇:水=77:23,等度洗脱;流速:1.0 mL/min;柱温:25℃。
1.5.不良事件评估
在整个研究过程中,由临床医生和护士观察受试者,密切监测患者的生命体征(包括体温、呼吸频率、血压和心率)、体格检查、症状(如疲倦、恶心、呕吐、厌食、腹泻等)及临床实验室检查(包括血液学、尿检、肝肾功能),并根据常见不良反应术语评定标准(CTCAE 5.0)来评估所有的不良事件。如果≥Ⅲ级,则被认为是严重不良事件,所有的不良事件均记录在原始数据记录中。
1.6.药代动力学及统计学分析
用DAS2.0软件对药代动力学参数进行非房室模型分析。绘制药物浓度-时间曲线,AUC0-24 h按线性梯形法则计算。应用SPSS 26.0软件对本研究数据进行统计分析,采用方差分析比较三组患者的年龄、体表面积、AUC0-24 h,不同组间的两两比较采用LSD法,采用卡方检验比较三组患者的性别、ECOG评分、不良反应发生率。定义检验水准为0.05,P<0.05为差异有统计学意义。
2.结果
从2021年5月到2023年1月,共有60名在空军军医大学第二附属医院接受顺铂IVC、HITHOC或HIPEC治疗的患者被纳入了研究,每组各20例患者,研究获得了所有患者的同意,并签署知情同意书。
2.1.患者特征
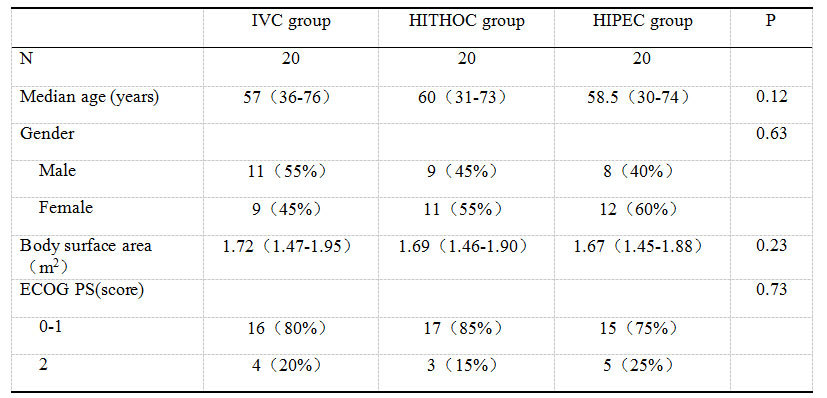
纳入的患者包括:肺癌23例,胃癌14例,卵巢癌11例,食管癌2例,腹膜间皮瘤2例,腹膜原发腺癌2例,胸腺癌1例,阑尾腺癌1例,宫颈癌1例,鼻咽癌1例,腮腺癌1例,头颈部鳞癌1例。患者包括28名男性和32名女性,所有患者均为汉族。患者的基线特征总结如表1所示,三组患者在年龄、性别、体表面积、ECOG评分上的差异均无统计学意义。
表1患者的基线特征
Table 1 Baseline characteristics of patients
2.2.药理学结果
将HITHOC组和HIPEC组患者同一时间点的灌流液浓度取平均值(表2),并绘制折线图(图4)。计算每个患者的AUC0-24 h,HITHOC组患者灌流液AUC0-24 h的均值72.36µg/mL·h,明显高于HIPEC组的均值36.03µg/mL·h,差异有统计学意义(P<0.01)。
表2 HITHOC组和HIPEC组患者的平均灌流液浓度(µg/mL)
Table 2 Mean perfusion fluid concentration(µg/mL)of patients in the HITHOC and HIPEC groups
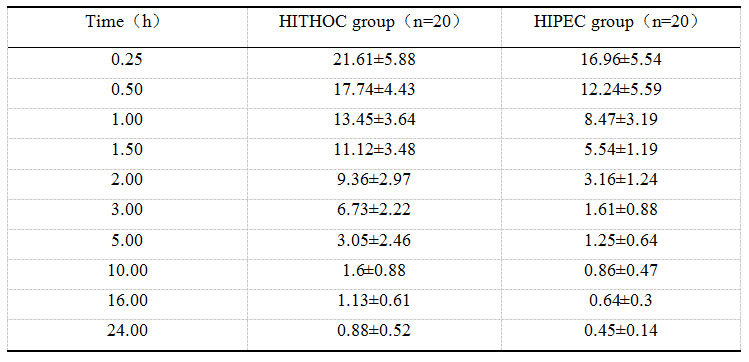
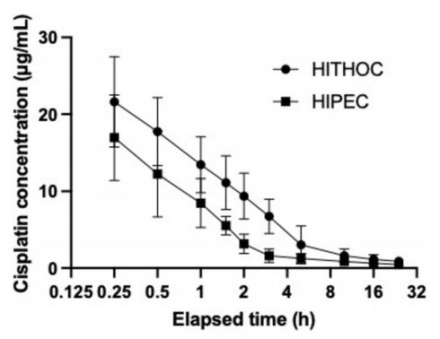
图4 HITHOC组和HIPEC组患者的平均灌流液浓度
Figure4 Mean perfusion fluid concentration of patients in the HITHOC and HIPEC groups
将各组患者同一时间点的血药浓度取平均值(表3),并绘制折线图(图5)。计算每个患者的AUC0-24 h,三组患者血浆AUC0-24 h的均值分别为:3.15µg/mL·h,2.57µg/mL·h,3.02µg/mL·h,差异有统计学意义(P<0.01)。将三组患者的血浆AUC0-24 h进行两两比较,IVC组和HITHOC组的差异有统计学意义(P<0.01),IVC组和HIPEC组的差异无统计学意义(P=0.47),HITHOC组和HIPEC组的差异有统计学意义(P=0.01)。
表3各组患者的平均血药浓度(µg/mL)
Table 3 Average blood drug concentration of patients in each group(µg/mL)
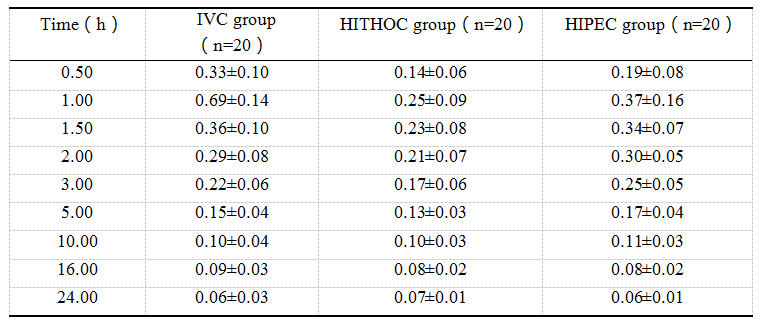
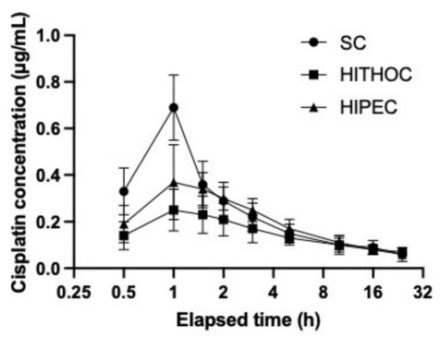
图5各组患者的平均血药浓度
Figure5 Average blood drug concentration of patients in each group
2.3.不良事件
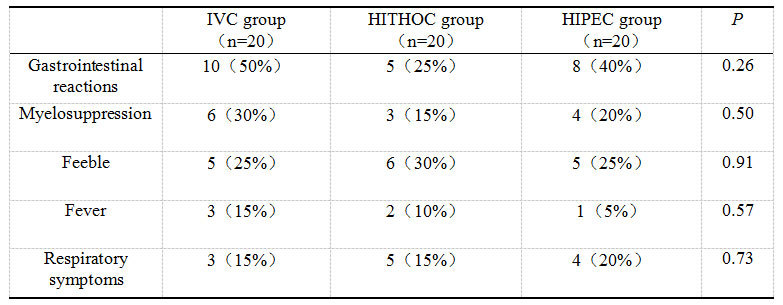
最常见的不良事件是胃肠道反应,主要为恶心、呕吐、便秘、腹胀、食欲下降、及腹泻等。其次为骨髓抑制,主要包括贫血、中性粒细胞减低、血小板减低等;较常见的还有发热、乏力、以及呼吸系统症状(包括咳嗽、呼吸困难等)。所有患者均未发生严重不良事件(≥Ⅲ级),三组患者的常见不良事件发生率无显著差异(表4)。HITHOC和HIPEC组患者的胸腹腔穿刺置管均为一次成功,实验过程中未发生穿刺失败事件。
表4三组患者的不良事件比较[例(%)]
Table 4 Comparison of adverse events among three groups of patients[cases(%)]
3.讨论
顺铂是很多实体瘤的基石治疗药物,在实体瘤导致的恶性胸腹水治疗中广泛应用,我们科长期以来采用内科闭合式胸腹腔热灌注化疗治疗恶性胸腹腔积液,达到了很好的疗效。
以往的HITHOC/HIPEC多采用胸/腹腔镜手术下留置导管,导管的管径较粗,需要全身麻醉,创伤较大,且在拔管后伤口愈合较慢,难以再次经手术置管,无法进行多周期的治疗。我们采用了一种新的HITHOC/HIPEC方案:在床旁超声引导下经胸/腹腔穿刺建立HITHOC/HIPEC闭合循环的进出水口,并留置导管,导管的管径较细,仅需局部浸润麻醉,创伤小,治疗3~4次后即可拔管,且在拔管后伤口愈合快,可反复多次穿刺置管,因此可进行多周期治疗。
基于顺铂的HITHOC及HIPEC已受到越来越多的重视,一些已发表的临床研究也提供了高水平的证据,支持HITHOC及HIPEC在临床中的应用[20,21]。然而,顺铂通过静脉给药和胸腹腔给药的药代动力学的研究尚鲜有报道。本研究采用高效液相色谱法,研究了顺铂经不同给药方式的药代动力学特征,观察不同给药方式在局部浓度和全身分布中的差异。
首先,我们比较了灌流液中的顺铂浓度。由图4可看出,HITHOC组患者的灌流液浓度较高,灌流液中的顺铂浓度最高可超过20µg/mL,且下降速度较慢,10h时下降至1.6µg/mL,趋于稳定,此时可认为胸腔中的顺铂基本被完全吸收;相比之下,HIPEC组患者的灌流液浓度较低,灌流液中的顺铂浓度最高为16.96µg/mL,下降速度较快,3h时下降至1.25µg/mL,趋于稳定,此时可认为腹腔中的顺铂已被完全吸收。
由于胸腔的容量有限,远低于腹腔,因此所用灌流液的量也较少,这就导致了胸腔灌流液中的顺铂浓度明显高于腹腔灌流液。此外,由于胸膜的面积远低于腹膜,导致了胸腔灌流液中顺铂的吸收速度明显低于腹腔灌流液,而较慢的吸收速度势必会导致较低的血药浓度。
由图5可知,由于IVC组是将顺铂直接注入静脉,所以患者的血药浓度升高最快,峰值也最高,可达0.69µg/mL,血药浓度在1h(即静滴结束)时达到峰值,后迅速下降,在10h时下降至0.1µg/mL,此后趋于稳定。HITHOC组和HIPEC组患者也在1h(即灌注结束)时达到血药浓度峰值,但其峰值较低,HITHOC组的血药浓度峰值为0.25µg/mL,HIPEC组的血药浓度峰值为0.37µg/mL。此外,相比于IVC组,HITHOC组和HIPEC组患者的血药浓度下降趋势更加平缓,可能是因为在胸腹腔热灌注化疗后,残留的药物经胸腹膜缓慢吸收入血,相当于在胸腹腔内置入了药物缓释剂,所以这两组的血药浓度曲线更加平滑。而胸腔灌流液中的顺铂吸收速度明显低于腹腔灌流液,因此HITHOC组的血药浓度峰值要低于HIPEC组。
HITHOC组患者灌流液中顺铂AUC0-24 h的均值为72.36µg/mL·h,血浆中顺铂AUC0-24 h的均值为2.57µg/mL·h,可大致认为HITHOC组患者胸腔中肿瘤细胞的24 h顺铂暴露总量是其血液中肿瘤细胞的28倍。HIPEC组患者灌流液中顺铂AUC0-24 h的均值为36.03µg/mL·h,血浆中顺铂AUC0-24 h的均值为3.02µg/mL·h,因此可大致认为HIPEC组患者腹腔中肿瘤细胞的24 h顺铂暴露总量是其血液中肿瘤细胞的12倍。综上所述,本研究证实了胸腹腔热灌注化疗可在胸腹腔内达到更高的药物浓度,有利于局部杀灭肿瘤细胞。
由三组患者血浆中顺铂AUC0-24 h的两两比较结果可知,对于HITHOC组患者,虽然胸腔局部的药物浓度更高,但由于其吸收入血的速度较慢,无法在血浆中达到较高的药物浓度,导致血浆中的顺铂AUC0-24 h未达到IVC组的水平,可认为基于顺铂的HITHOC无法达到相同剂量顺铂IVC的全身治疗效果。因此对于仅需要局部治疗的恶性胸水患者,HITHOC可在局部杀伤肿瘤的同时,带来较低的全身毒性,不良反应可能更少;对于需要全身治疗的恶性胸水患者(如存在胸膜以外的其他病灶),可适当增加顺铂的剂量,以增加血浆中的顺铂浓度,在提高局部药物浓度的同时,达到标准剂量IVC的全身治疗效果。笔者猜测,对于此类患者,顺铂HITHOC的最佳给药剂量可能为IVC标准剂量的1.2~1.8倍,但此猜想有待进一步的实验验证。
对于HIPEC组患者,不仅可在腹腔局部形成很高的药物浓度,在血浆中同样可以达到较高的药物浓度,血浆中的顺铂AUC0-24 h可达到IVC组的水平,因此可认为基于顺铂的HIPEC可达到相同剂量顺铂IVC的全身治疗效果。
在不良反应方面,三组患者无明显差异,HITHOC和HIPEC均未带来穿刺相关不良事件(如气胸、腹膜炎等),说明HITHOC和HIPEC的安全性好、不良反应可控。
应该强调的是,本研究首次比较了相同剂量的顺铂经IVC、HITHOC、HIPEC给药后的血药浓度,证明了床旁内科式HITHOC无法达到相同剂量顺铂IVC的全身治疗效果,而床旁内科式HIPEC则可达到相同剂量顺铂IVC的全身治疗效果。我们的研究结果对于HITHOC及HIPEC的临床应用有着积极的指导意义,这也为确定HITHOC及HIPEC时的最佳给药剂量提供了强有力的实验基础。
同时,本研究也存在一些不足:首先,所有患者所用的顺铂均为分3次给药,为了使3组患者均衡可比,所有患者在首次给药时的剂量均为40 mg,考虑到采血过多会导致患者依从性差,因此我们只比较了首次给药后的药物浓度,未采集到后两次给药后的药物浓度数据。其次,本研究的样本来源不够均衡,三组患者原发肿瘤的种类较多,分期也不尽相同,HITHOC组以肺癌患者为主,HIPEC组却几乎没有肺癌患者,由于患者的组织学类型、既往接受的治疗方案和后续的治疗差异均会影响患者的总体生存期,因此我们仅比较了三组患者的药物浓度和不良反应,并未比较患者的总生存期、客观缓解率等数据。如果想证实HITHOC及HIPEC的临床疗效,需要进一步的临床试验。
本人承诺本文资料真实,无抄袭剽窃他人成果,无一稿多投、重复发表等学术不端行为;不涉及任何形式之保密义务;文章符合医学伦理学基本原则。并承诺承担一切违反义务和侵权的责任,论文中涉及的原始图片、数据资料等已按照有关规定保存,可以接受核查。全部作者均声明不存在利益冲突,并签署了论文授权书等协议。本文已经本人认真校对,内容真实无误,文责自负,请以此稿为准。
【基金项目】国家自然科学基金资助项目(项目编号:81372608)
【作者单位】空军军医大学第二附属医院肿瘤科,陕西西安710038
【作者简介】宋杰(1975-),女,陕西西安人,主管护师,主要从事腹腔热灌注化疗的相关研究。E-mail:1028190806 qq.com
【通讯作者】刘理礼(1972-),女,河北乐亭人,副教授,主要从事肿瘤转移机制研究及胸腹腔热灌注研究。E-mail:lily123fmmu 163.com
【联系电话】宋杰13891931018
【通讯地址】陕西省西安市灞桥区新寺路569号唐都医院肿瘤科宋杰(收)邮编:710038
[1]SPILIOTIS J,HALKIA E,DE BREE E.Treatment of peritoneal surface malignancies with hyperthermic intraperitoneal chemotherapy-current perspectives[J].Current oncology(Toronto,Ont),2016,23(3):e266-275.
[2]DI LEO A,CORVASCE A,WEINDELMAYER J,et al.Cytoreductive surgery(CRS)and hyperthermic intraperitoneal chemotherapy(HIPEC)in pseudomyxoma peritonei of appendiceal origin:result of a single centre study[J].Updates in surgery,2020,72(4):1207-1212.
[3]MORRIS M C,DHAR V K,STEVENSON M A,et al.Adjuvant Hyperthermic Intraperitoneal Chemotherapy(HIPEC)for patients at High-Risk of Peritoneal Metastases[J].Surgical oncology,2019,31:33-37.
[4]FAVIANA P,BOLDRINI L,MUSCO B,et al.Management of Peritoneal Carcinomatosis With Cytoreductive Surgery Combined With Intraperitoneal Chemohyperthermia at a Novel Italian Center[J].In vivo(Athens,Greece),2020,34(4):2061-2066.
[5]JIAO J,LI C,YU G,et al.Efficacy of hyperthermic intraperitoneal chemotherapy(HIPEC)in the management of malignant ascites[J].World journal of surgical oncology,2020,18(1):180.
[6]RIED M,EICHHORN M,WINTER H,et al.[Expert Recommendation for the Implementation of Hyperthermic Intrathoracic Chemotherapy(HITOC)in Germany][J].Zentralblatt fur Chirurgie,2020,145(1):89-98.
[7]LI Y,ZHOU Y F,LIANG H,et al.Chinese expert consensus on cytoreductive surgery and hyperthermic intraperitoneal chemotherapy for peritoneal malignancies[J].World journal of gastroenterology,2016,22(30):6906-6916.
[8]TURAGA K,LEVINE E,BARONE R,et al.Consensus guidelines from The American Society of Peritoneal Surface Malignancies on standardizing the delivery of hyperthermic intraperitoneal chemotherapy(HIPEC)in colorectal cancer patients in the United States[J].Annals of surgical oncology,2014,21(5):1501-1505.
[9]WONG E Y T,TAN G H C,CHIA C S L,et al.Morbidity and mortality of elderly patients following cytoreductive surgery and Hyperthermic Intraperitoneal Chemotherapy(HIPEC)[J].Asia-Pacific journal of clinical oncology,2018,14(2):e193-e202.
[10]TSUYOSHI H,INOUE D,KUROKAWA T,et al.Hyperthermic intraperitoneal chemotherapy(HIPEC)for gynecological cancer[J].The journal of obstetrics and gynaecology research,2020,46(9):1661-1671.
[11]LU C,LI L,LUO Z,et al.Clinical efficacy of type-B ultrasound-guided intraperitoneal hyperthermic chemoperfusion combined with systemic chemotherapy in advanced gastric cancer patients with malignant ascites[J].Neoplasma,2016,63(2):299-303.
[12]LIU L,ZHANG N,MIN J,et al.Retrospective analysis on the safety of 5,759 times of bedside hyperthermic intra-peritoneal or intra-pleural chemotherapy(HIPEC)[J].Oncotarget,2016,7(16):21570-21578.
[13]LIU L,SUN L,ZHANG N,et al.A novel method of bedside hyperthermic intraperitoneal chemotherapy as adjuvant therapy for stage-III gastric cancer[J].International journal of hyperthermia:the official journal of European Society for Hyperthermic Oncology,North American Hyperthermia Group,2022,39(1):239-245.
[14]CEELEN W P,VAN NIEUWENHOVE Y,VAN BELLE S,et al.Cytoreduction and hyperthermic intraperitoneal chemoperfusion in women with heavily pretreated recurrent ovarian cancer[J].Annals of surgical oncology,2012,19(7):2352-2359.
[15]REICHMAN T W,CRACCHIOLO B,SAMA J,et al.Cytoreductive surgery and intraoperative hyperthermic chemoperfusion for advanced ovarian carcinoma[J].Journal of surgical oncology,2005,90(2):51-56;discussion 56-58.
[16]KöNIGSRAINER I,HORVATH P,STRULLER F,et al.Cytoreductive surgery and hyperthermic intraperitoneal chemotherapy in recurrent epithelial ovarian cancer with peritoneal metastases:a single centre experience[J].Langenbeck's archives of surgery,2014,399(5):589-594.
[17]COTTE E,COLOMBAN O,GUITTON J,et al.Population pharmacokinetics and pharmacodynamics of cisplatinum during hyperthermic intraperitoneal chemotherapy using a closed abdominal procedure[J].Journal of clinical pharmacology,2011,51(1):9-18.
[18]ANSALONI L,COCCOLINI F,MOROSI L,et al.Pharmacokinetics of concomitant cisplatin and paclitaxel administered by hyperthermic intraperitoneal chemotherapy to patients with peritoneal carcinomatosis from epithelial ovarian cancer[J].British journal of cancer,2015,112(2):306-312.
[19]ZIVANOVIC O,ABRAMIAN A,KULLMANN M,et al.HIPEC ROC I:a phase I study of cisplatin administered as hyperthermic intraoperative intraperitoneal chemoperfusion followed by postoperative intravenous platinum-based chemotherapy in patients with platinum-sensitive recurrent epithelial ovarian cancer[J].International journal of cancer,2015,136(3):699-708.
[20]AMBROGI M C,KORASIDIS S,LUCCHI M,et al.Pleural recurrence of thymoma:surgical resection followed by hyperthermic intrathoracic perfusion chemotherapy†[J].European journal of cardio-thoracic surgery:official journal of the European Association for Cardio-thoracic Surgery,2016,49(1):321-326.
[21]VAN DRIEL W J,KOOLE S N,SIKORSKA K,et al.Hyperthermic Intraperitoneal Chemotherapy in Ovarian Cancer[J].N Engl J Med,2018,378(3):230-240.