好博士·热灌注丨转载1:临床或实验室研究进展--小肠移植术治疗腹膜假黏液瘤
腹膜假黏液瘤是一种罕见的临床综合征, 其特征为黏液性腹水、 腹膜种植及大网膜饼形成 。绝大部分腹膜假黏液瘤起源于 阑尾黏液性肿瘤穿孔, 少数起源于其他脏器, 如卵巢、脐尿管、结肠 、胰腺等。黏液性肿瘤穿孔导致黏蛋白及产生黏蛋白 的上皮细胞脱落进入腹腔, 通过再分布现象, 依次扩散至右结肠旁沟、右膈下间隙、左膈下间隙(包括脾脏)、大网膜 、 及盆底(女性包括卵巢和子宫) [Carr NJ et al., Am J Surg Pathol. 2016] 。腹膜假黏液瘤通常进展缓慢, 较少发生淋巴道转移 和远处转移。
2025-04-29
小肠移植术治疗腹膜假黏液瘤
ByNadaAyoub*, SrikanthReddy^ andTomCecil*
*PeritonealMalignancyInstitute, HampshireHospitalsNHSFoundationTrust, Basingstoke, UK
^OxfordTransplantCentre, OxfordUniversityHospitalsNHSFoundationTrust, Oxford,UK
前言
腹膜假黏液瘤是一种罕见的临床综合征,其特征为黏液性腹水、腹膜种植及大网膜饼形成。绝大部分腹膜假黏液瘤起源于阑尾黏液性肿瘤穿孔,少数起源于其他脏器,如卵巢、脐尿管、结肠、胰腺等。黏液性肿瘤穿孔导致黏蛋白及产生黏蛋白的上皮细胞脱落进入腹腔,通过再分布现象,依次扩散至右结肠旁沟、右膈下间隙、左膈下间隙(包括脾脏)、大网膜、及盆底(女性包括卵巢和子宫)[CarrNJetal., AmJSurgPathol.2016]。腹膜假黏液瘤通常进展缓慢,较少发生淋巴道转移和远处转移。
目前,肿瘤细胞减灭术加腹腔热灌注化疗是腹膜假黏液瘤的标准治疗方案,即通过脏器和腹膜联合切除,尽可能清除所有肉眼可见肿瘤,随后行术中腹腔热灌注化疗,热灌注化疗药物通常使用丝裂霉素 C。经典的肿瘤细胞减灭术包括壁腹膜切除、大小网膜切除、阑尾切除或右半结肠切除(适用于高级别阑尾黏液性肿瘤、杯状细胞腺癌或右半结肠黏液腺癌),女性患者通常行双附件联合子宫切除。根据肿瘤累及范围,选择性行左右膈肌腹膜切除、盆腔腹膜切除、脾切除、胃肠道切除以及肝被膜切除[SugarbakerPH. SurgOncolClinNAm2003]。最多 80%的腹膜假黏液瘤患者,能够实现完全肿瘤细胞减灭。
然而,即便接受了完全肿瘤细胞减灭术和腹腔热灌注化疗,仍有 22%至 44%的患者出现复发,其中部分患者无法再次接受肿瘤细胞减灭术。部分患者,因小肠广泛受累,无法实现肿瘤完全切除,仅能接受最大限度的传统减瘤术,残余病灶持续进展则不可避免[AhmadiNetal., AnnSurgOncol.2021]。
由于小肠广泛受累,患者会逐渐出现腹胀和营养衰竭,需要肠外营养支持。此疾病阶段腹壁缺损和肠瘘很常见,使得有效缓解病情变得愈发困难甚至无法实现,患者特别痛苦。受患者StevePrescott的故事推动和启发[Oneinamillion:Mystory VerticalEditionsISBN-13 978-1904091844],基于此疾病阶段的临床特点以及腹膜假黏液瘤进展相对缓慢的特性,医生们开始寻找手术解决方案。最终,改良多脏器移植/小肠移植可能成为治疗和缓解此类患者病情的手术方案,并有望提高患者生存率,改善生活质量。
小肠移植
目前,小肠移植已成为一种成熟的治疗选择,用于治疗越来越多的疾病。然而,小肠移植与其他实体器官移植(如肾移植、肝脏移植)相比,病发症发生率更高,患者生存率更低。
下图概述了小肠移植的不同方案,移植物的复杂程度决定了手术风险和结局。
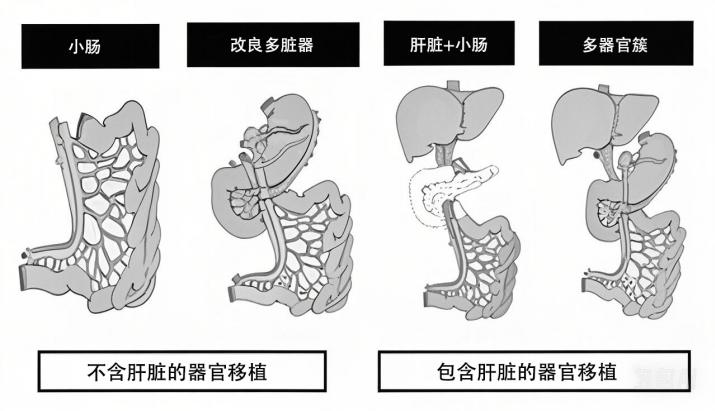
小肠移植治疗腹膜假黏液瘤
贝辛斯托克腹膜恶性肿瘤研究所的腹膜假黏液瘤团队与牛津大学的移植团队联合开展了针对终末期腹膜假黏液瘤的小肠移植项目。 下文将从手术方法、经验教训和临床结局等方面,讨论 15 例单纯小肠移植或改良多脏器移植术。
多脏器移植/小肠移植的纳入标准
1.腹膜癌指数为 30-39的弥漫性腹膜假黏液瘤,小肠受累且无有效化疗方案和常规手术方案。
2.根据国际腹膜癌联盟(PSOGI)的病理分类标准,属于低级别病变或进展缓慢的高级别病变。
3. 营养衰竭,需要或即将需要肠外营养支持。
多脏器移植/小肠移植的排除标准
1. 存在远处转移。
2. 严重的心脏或其他器官功能不全,致使患者无法耐受移植手术。
3. 病情严重,移植手术可能无法缓解,预期寿命短。
4. 患者依从性差,不遵医嘱对移植器官构成风险。
5. 患者不接受使用免疫抑制药物的潜在并发症。
6.获得性免疫缺陷综合征(艾滋病)(根据 CDC标准进行诊断:CD4+ 细胞计数≤200 / mm³),除非满足以下标准:
a. CD4+ 细胞计数> 200/mm³且持续时间超过六个月。
b.人类免疫缺陷病毒1型(HIV-1)的核糖核酸(RNA)检测阴性。.
c. 接受稳定的抗逆转录病毒疗法超过三个月。
d.无其他艾滋病相关并发症(机会性感染,如曲霉病、结核病、球孢子菌病、耐药真菌感染;卡波西肉瘤或其他肿瘤)。
e. 符合小肠移植或多脏器联合移植的所有其他标准。
供体手术
从所有供体中,均获取改良多脏器联合移植物,包括胃、胰十二指肠、小肠和右半结肠。此外,如有需要,还会获取带腹壁下血管蒂的全层腹壁。
受体手术
一旦确认供体器官适宜,受体手术立即开始,充分利用了通常耗时较长的获取过程,游离切除受侵肠道。大约一半的患者,由于肿瘤广泛浸润,需要切除十二指肠、胰腺、胃、小肠和大肠。
根据腹部器官受累程度选择移植物, 原则是保证有效肿瘤切除的前提下,移植所需的最少供体组织。部分患者上腹部肿瘤复发较少,可以保留胃、十二指肠和胰腺。尽管力求实现完全肿瘤细胞减灭,但出于安全考虑,有时仍会少量残留,尤其是在肝门或膈肌区域。在某些病例中,应用高功率电刀烧灼肝被膜切除肝表面肿瘤。
对于单纯肠道移植,血管重建包括供体肠系膜上血管与受体吻合。在多脏器联合移植中,取供体胸主动脉段作为受体肾下主动脉血管桥, 与包含供体肠系膜上动脉和腹腔干的卡雷尔血管片吻合,通过与受体门静脉吻合建立静脉回流通路。
|
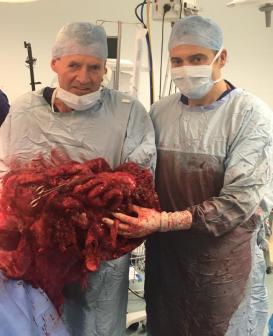
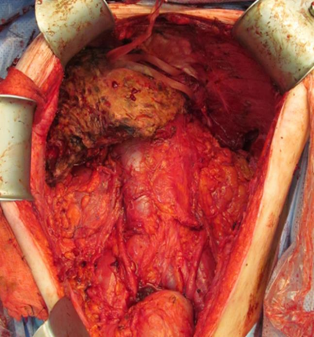
腹膜假黏液瘤切除标本 |
腹膜假黏液瘤切除标本 |
腹壁移植
对于肿瘤切除后广泛腹壁缺损的患者,腹腔容积减小,整形外科医生将供体腹壁作为游离皮瓣进行移植,通过显微血管吻合术与受体腹壁下血管系统吻合。此外,若患者自身皮肤保留足够,也可直接使用供体的腹部筋膜进行修复[Reddyetal.,AnnSurg2023]。
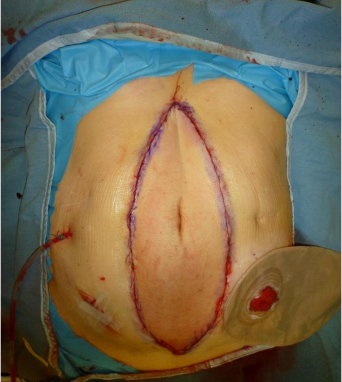
腹壁移植
免疫抑制方案
• 再灌注前静脉注射 500mg甲强龙。
• 术中再灌注后静脉注射阿仑单抗30mg,24 小时后给予第二剂。
• 他克莫司用于维持治疗,在前六个月内,目标最低血药浓度为10-12ng/mL,之后降为8–10ng/mL。
• 自2018年以来,补充的免疫抑制治疗方案包括:
o 硫唑嘌呤(50–75mg,每日一次)。
o 吗替麦考酚酯(250-500mg,每日两次)。
o 泼尼松龙(5–10mg,每日一次)。
排斥反应的诊断与治疗
小肠的排斥反应通过内镜检查和活检来诊断,并根据第八届国际小肠移植研讨会制定的标准进行分级。对于接受腹壁移植的患者,如果出现皮疹,则进行皮肤活检, 并依据2007Banff标准评估。
排斥反应的治疗措施包括连续三天静脉注射甲强龙,同时调整免疫抑制治疗方案。对于持续性或严重排斥反应,则会额外使用抗胸腺细胞球蛋白进行处理。
肠移植失败
肠移植失败定义为移植后出现以下任何一种情况:
1. 因任何原因进行的移植肠切除术,包括吻合口漏、出血、缺血、排斥反应、感染、恶性肿瘤以及移植物抗宿主病(GVHD)。
2. 重新登记等待再次肠移植。
3.依赖全胃肠外营养:
o 移植后重新开始全胃肠外营养。
o 移植后三个月内无法停止全胃肠外营养。
结果
中位随访 4.5年,6 名患者移植后死亡,其中1 人在移植后1 个月内死亡,另外2 人(13%)在移植后1-6 个月之间死亡,其余 3 人(20%)在移植 6 个月后死亡。死亡原因各不相同,包括术后第 24 天因吻合口漏死亡 1 例、术后第 69 天因上消化道出血死亡1 例,术后第181天因移植物抗宿主病死亡1 例,其他死亡原因还包括术后第 1001天因多种病发症接受姑息治疗后死亡 1 例、术后第 1204天因疾病进展死亡 1 例,以及术后第 1300天因移植后淋巴增生性疾病死亡1 例。
尽管面临这些挑战,大多数幸存者实现了自主营养。在移植后存活超过1个月的14例患者中,12例成功摆脱了全胃肠外营养,其他 2 例出现了肠瘘,仍需接受胃肠外营养。移植 1 年后,72%(8/11)的患者不再需要居家胃肠外营养支持,但后来 2 名患者因移植后病发症,包括淋巴组织增生性疾病和盆腔肿瘤复发,需要居家胃肠外营养补充。与此同时,肿瘤进展或复发仍是重大难题,在至少 6 个月的随访中,91%的患者受到影响。复发的中位时间不到一年,为363 天,范围在110 天至 727 天之间[Reddyetal.,AnnSurg2023]。
本研究发现, 对于经过仔细选择的、无其他手术机会的终末期腹膜假黏液瘤患者,改良多脏器移植和小肠移植具有可行性。首批接受该治疗患者的随访结果显示,1年生存率为78%,5年生存率为55%,绝大多数患者生活质量有显著改善。影响手术成功的关键因素包括严格的病例筛选,优先选择低级别腹膜假黏液瘤,年轻且健康状况良好的患者,即便在肿瘤负荷高的病例中,尤其是既往开腹手术失败的病例,也要确保近乎彻底的肿瘤细胞减灭。
腹壁受累给所有患者带来了挑战,近一半(7/15)患者因肿瘤浸润和组织破坏出现严重的腹腔容积减小。在这些病例中,因为移植器官承受的张力过大会增加手术风险,而无法进行一期缝合。尽管存在这些障碍, 但生存结果仍然充满希望。79%的 1 年生存率与全球小肠移植标准相符,而 55%的5 年生存率略低于非腹膜假黏液瘤小肠移植所报告的60%-70%。然而,这些结果远远优于仅接受胃肠外营养治疗的无法切除的腹膜假黏液瘤患者的预后,这类患者通常仅能存活 6-12 个月。值得注意的是,改良多脏器移植的 5 年生存率也超过了诸如胰腺癌切除术等主流癌症手术结果,凸显了其作为治疗这一棘手疾病的潜在价值[Reddyetal., AnnSurg2023]。
尽管在腹膜假黏液瘤的移植治疗中,高复发率仍然是一个难题,但谨慎的病例选择以及不断提升的手术专业技能为改善治疗效果带来了希望。对于特定的腺癌患者,移植已显示出潜在获益。而且,尽管在免疫抑制的情况下肿瘤会复发,但大多数病例病情进展缓慢。值得注意的是,在本研究中的 15 个死亡病例里,只有 1 例是直接死于肿瘤复发。
2021 年,美国 AnilVaidya医生实施了一项开创性的技术,为多脏器移植引入了一种创新方法。在该案例中,肝脏和肠道进行了联合移植,同时还进行了脾脏的暂时性移植,以增强免疫保护并改善胰腺的血液供应。此外,右半结肠也进行了暂时性移植, 以帮助保护新移植的肠道免受感染,并辅助营养物质的吸收。在脾脏和结肠成功地完成了它们保护新移植器官的暂时性使命后,这两个器官随后都被切除。
尽管取得了这些进展,但该研究的样本量较小,且患者群体经过了高度筛选,这限制了其在更广范围内的适用性。仍有几个关键问题尚未得到解答,其中包括移植的最佳时机、移植在治疗更高级别疾病方面的潜在作用,以及在肿瘤切除时联合实施腹腔热灌注化疗是否能够改善对疾病的控制等。在这个复杂且不断发展的移植领域,未来的研究对于完善患者选择标准以及探索提高长期生存率的方法至关重要。
总之,对于经选择的终末期腹膜假黏液瘤患者而言,小肠移植是一种可行的治疗选择,能够实现长期生存并改善生活质量。未来还需要进一步的研究来完善患者选择标准,并探索辅助治疗方法, 以提升疗效。
转载自:

关键词:
相关新闻